Chưa có sản phẩm trong giỏ hàng.
Đối với phần lớn chúng ta, H2O là nước, thật đơn giản và dễ hiểu. Thế nhưng, khi nhìn nhận H2O là gì dưới góc độ khoa học, bạn sẽ khám phá ra một thế giới hoàn toàn khác: Một vật chất tưởng chừng quen thuộc nhưng lại ẩn chứa vô vàn bí ẩn và thú vị đến thế!
1. Hiểu đúng H2O là gì
H2O là công thức hóa học quen thuộc của phân tử nước, loại vật chất thiết yếu được Empedocles (Nhà triết học người Hy Lạp cổ đại) coi là chất cơ bản của vũ trụ và là khởi nguồn của các loại chất khác. Trong ký hiệu H2O là gì:
- H đại diện cho nguyên tố Hydro hay Hydrogen
- O đại diện cho nguyên tố Oxy hoặc Oxygen
- Chỉ số 2 cho biết có 2 nguyên tử Hydro liên kết với 1 nguyên tử Oxy để tạo thành một phân tử H2O hoàn chỉnh

Để dễ hình dung hãy cùng tưởng tượng, mỗi giọt nước bạn nhìn thấy đều được cấu thành từ vô số phân tử H2O nhỏ bé, trong đó 2 hạt Hydro ôm lấy một hạt Oxy, tạo nên tính chất độc đáo của nước mà chúng ta vẫn sử dụng mỗi ngày. Đây cũng là nền tảng để hiểu rõ hơn về H2O là gì trong hóa học và đời sống.
2. Cấu trúc của phân tử H2O là gì
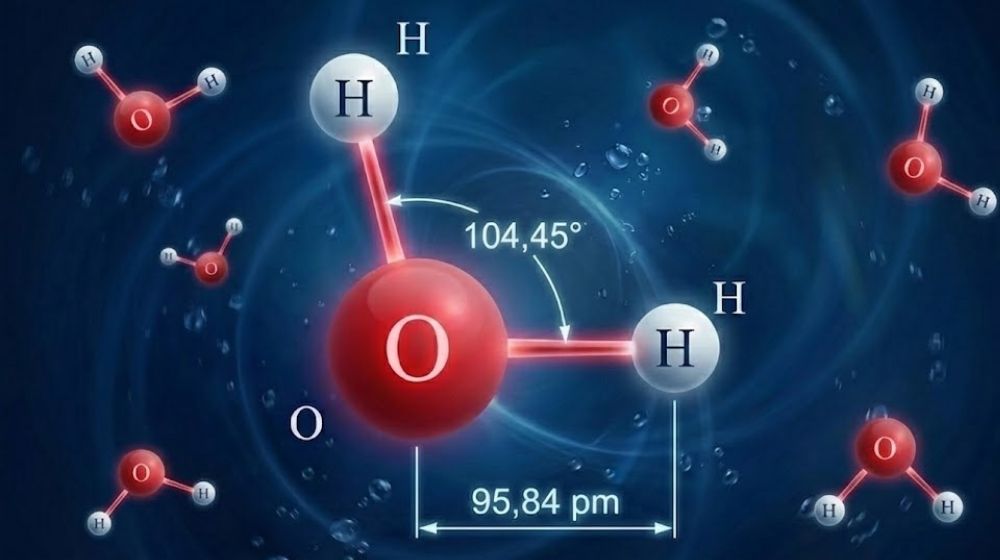
Phân tử H2O có cấu trúc hình học đặc trưng tạo nên tính chất vật lý và hóa học riêng biệt. Sự sắp xếp các nguyên tử và góc liên kết trong phân tử khiến H2O trở thành một phân tử phân cực mạnh, góp phần tạo nên nhiều hiện tượng tự nhiên quan trọng.
- Góc liên kết (H–O–H): 104,45° – góc này nhỏ hơn góc lý thuyết của hình tứ diện do các cặp electron tự do trên nguyên tử O chiếm nhiều không gian và đẩy các liên kết H–O lại gần nhau.
- Chiều dài liên kết (O → H): 95,84pm (picômét) – đây là khoảng cách giữa nguyên tử oxy và nguyên tử hydro trong mỗi liên kết của phân tử H2O
3. Các trạng thái vật lý của H2O
H2O tồn tại tự nhiên ở ba trạng thái vật lý khác nhau, tùy thuộc vào nhiệt độ và áp suất của môi trường:
- Rắn: Khi nhiệt độ ≤ 0°C, các phân tử H2O liên kết chặt chẽ và sắp xếp thành mạng tinh thể, tạo nên băng có mật độ thấp hơn H2O lỏng nên có thể nổi trên mặt. Điển hình là băng và tuyết
- Lỏng: Ở điều kiện thường (20°C), các phân tử H2O chuyển động linh hoạt nhưng vẫn có liên kết hydro tạm thời và ở đây chính là nước
- Khí: Khi nhiệt độ tăng cao, liên kết giữa các phân tử H2O bị phá vỡ, H2O bay hơi thành dạng khí và hòa vào không khí. Hơi H2O có vai trò quan trọng trong chu trình điều hòa khí hậu

Ngoài ra, trong điều kiện đặc biệt (như áp suất rất cao) thuộc chuyên ngành vật lý chất rắn, H2O còn có thể xuất hiện ở một số dạng rắn đặc biệt như băng II, băng V, băng VI,…, thường gặp ở các thiên thể khác trong vũ trụ
4. Liên kết hydrogen của H2O là gì
Liên kết hydrogen (hydrogen bond) là lực hút tĩnh điện yếu nhưng có vai trò đặc biệt quan trọng, hình thành giữa nguyên tử hydro mang điện dương nhẹ của một phân tử H2O và nguyên tử oxy mang điện âm nhẹ của phân tử H2O lân cận. Nhờ tính phân cực của H2O, các phân tử liên tục tương tác và tạo thành mạng lưới liên kết đặc trưng.
- Liên kết hydro không bền, chỉ tồn tại trong 1 phần rất nhỏ của 1 giây, rồi các phân tử tách ra và hình thành liên kết mới
- Đường kính nhỏ của nguyên tử hydro giúp tiến gần oxy, tạo điều kiện hình thành liên kết
- Liên kết hydro tạo nên các tính chất quan trọng của nước như nhiệt dung cao, sức căng bề mặt lớn và cấu trúc mạng lưới trong nước lỏng
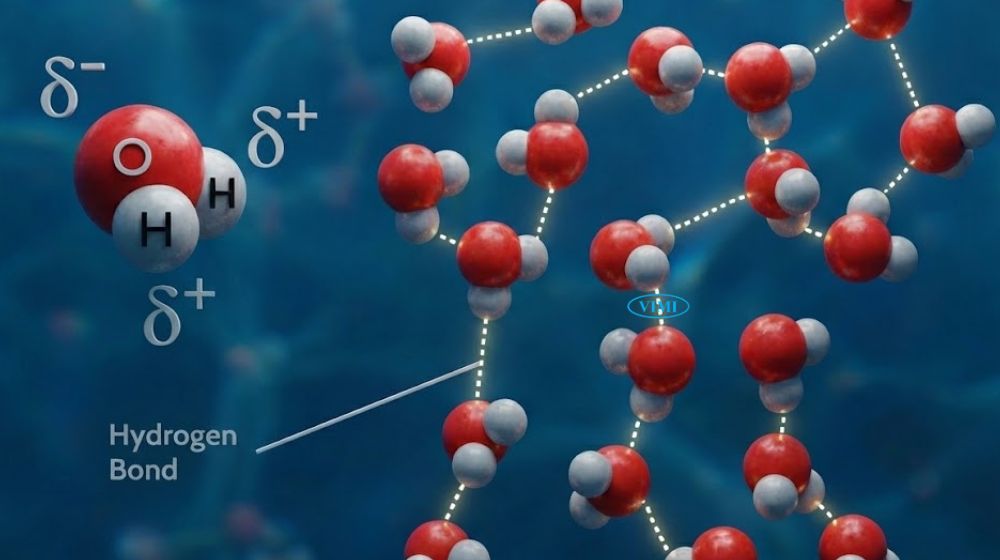
Đây cũng là yếu tố cốt lõi giúp giải thích H2O là gì và vì sao lại có tính chất độc đáo đến vậy
5. Tính lưỡng cực của H2O là gì
Phân tử H2O mang tính lưỡng cực (polar) do sự phân bố điện tích không đồng đều giữa nguyên tử oxy và hai nguyên tử hydro. Điều này tạo ra một đầu mang điện tích âm nhẹ và một đầu mang điện tích dương nhẹ, khiến H2O trở thành một phân tử có mô men lưỡng cực
- Sự khác biệt về độ âm điện:
- Oxy có độ âm điện lớn hơn hydro, nên electron trong liên kết O–H bị kéo về phía oxy
- Điều này tạo ra cực âm ở vùng gần nguyên tử oxy và cực dương ở vùng gần hai nguyên tử hydro
- Tác động của phân tử bẻ góc:
- Góc liên kết của H2O là 104,45°, không phải đường thẳng
- Hình dạng bẻ góc khiến các mô men lưỡng cực của hai liên kết O–H không triệt tiêu nhau, tạo nên mô men lưỡng cực tổng
⇒ Kết quả: Phân tử nước có đầu âm – đầu dương rõ rệt. Tính lưỡng cực này giúp nước hòa tan tốt nhiều chất, tạo liên kết hydro, có hằng số điện môi cao và hấp thụ được sóng cực ngắn như trong lò vi sóng
6. Cách điều chế H2O là gì
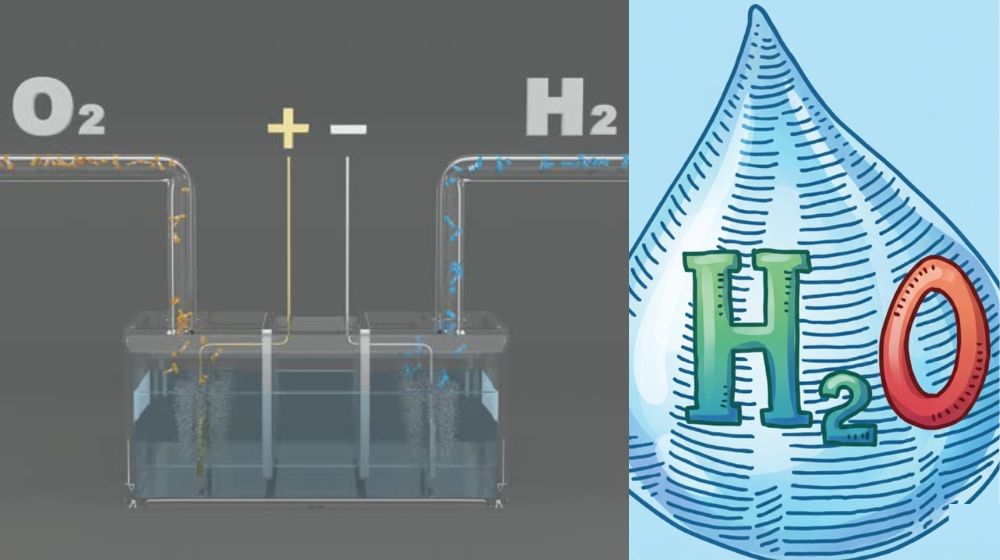
H2O có thể được điều chế bằng nhiều phương pháp khác nhau, trong đó phổ biến nhất là phản ứng hóa hợp giữa hydro và oxi. Tuy nhiên, do hỗn hợp H2 và O2 dễ phát nổ (đặc biệt ở tỉ lệ 2:1), các phương pháp an toàn hơn thường được ưu tiên trong thực tế.
6.1 Phản ứng trực tiếp trong phòng thí nghiệm
Phản ứng hóa học giữa H2 và O2 là cách đơn giản nhất để tạo ra H2O, nhưng chỉ được thực hiện trong phòng thí nghiệm với điều kiện kiểm soát nghiêm ngặt
- Khi trộn H2 và O2 theo đúng tỉ lệ 2:1 và kích hoạt bằng tia lửa điện, hỗn hợp sẽ phản ứng mãnh liệt, tỏa nhiệt lớn và tạo thành H2O theo phương trình 2H2 + O2 → 2H2O
- Do hỗn hợp hai khí này cực kỳ dễ phát nổ, thí nghiệm chỉ tiến hành ở quy mô nhỏ, trong thiết bị kín và có bộ phận an toàn nhằm hạn chế tối đa rủi ro

6.2 Điều chế H2O trong công nghiệp
Trong công nghiệp, nước thường không được tạo ra trực tiếp bằng H2 + O2 vì tính nguy hiểm đã nêu ở phần trước, mà chủ yếu là thành phẩm phụ của việc đốt nhiên liệu chứa hydro hoặc được thu hồi và làm tinh khiết từ nguồn sẵn có:
- Đốt cháy methane (khí thiên nhiên) theo phương trình: CH4 + 2O2 → CO2 + 2H2O. Đây là một nguồn lớn tạo H2O (thể khí) trong các nồi hơi, turbine và lò đốt, H2O sau đó được dẫn qua các van hơi nóng đến buồng ngưng tụ và thu hồi
- Chưng cất chất rắn hòa tan (ví dụ như muối): Dùng nhiệt để bốc hơi H2O khỏi dung dịch muối, ngưng tụ lại thành H2O tinh khiết, tách muối và tạp chất không bay hơi
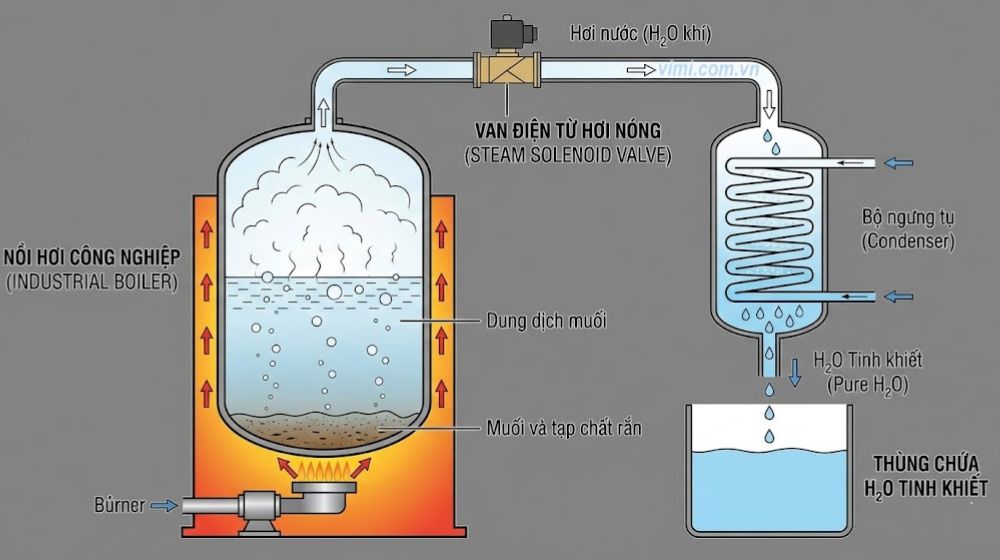
6.3 Thu H2O trong các hệ thống dân dụng
Trong dân dụng, H2O (nước) không được tạo ra bằng phản ứng hóa học mà được thu gom và xử lý từ các nguồn sẵn có như nước máy, nước giếng hoặc nước mưa. Sau khi thu, H2O được dẫn qua các bước xử lý phổ biến như lọc thô, than hoạt tính, màng RO và khử khuẩn UV để loại bỏ cặn, ion kim loại và vi sinh, đảm bảo H2O đạt tiêu chuẩn cho sinh hoạt và ăn uống

Nhờ các phương pháp điều chế và thu hồi đa dạng, chúng ta có thể hiểu rõ hơn H2O là gì trong bối cảnh sản xuất và ứng dụng thực tiễn
7. Vai trò của H2O là gì đối với Trái Đất
H2O là thành phần then chốt của hệ sinh thái Trái Đất, ảnh hưởng trực tiếp tới khí hậu, sinh học, hoạt động kinh tế và từ đồng ruộng đến nhà máy. Dưới đây là các vai trò chính của H2O, được tách rõ theo từng lĩnh vực.
- Điều hòa khí hậu: H2O tham gia chu trình bay hơi – ngưng tụ – mưa, giúp ổn định nhiệt độ và phân bố lượng mưa
- Duy trì sự sống: H2O là dung môi cho hầu hết phản ứng sinh hóa, vận chuyển dinh dưỡng và duy trì cấu trúc tế bào
- Hình thành địa hình tự nhiên: Dòng chảy H2O bào mòn, vận chuyển và bồi đắp khoáng chất, tạo sông, hồ và biển
- Phục vụ nông nghiệp: H2O quyết định năng suất cây trồng và chăn nuôi thông qua tưới tiêu và quản lý đất
- Ứng dụng trong công nghiệp: H2O dùng làm dung môi, môi chất làm mát, chất vận chuyển và đầu vào cho nhiều quy trình sản xuất
- Sản xuất năng lượng: H2O vận hành tuabin, van thủy lực và cung cấp hơi nước cho các hệ thống phát điện
- Vai trò trong đời sống: H2O phục vụ ăn uống, vệ sinh, xử lý nước thải và duy trì chất lượng đô thị.

Các vai trò này góp phần trả lời trọn vẹn câu hỏi H2O là gì khi xét trên phương diện sinh học, môi trường và công nghiệp
8. Tại sao nói H2O là một oxit lưỡng tính
H2O được xem là một oxit lưỡng tính vì có thể phản ứng được cả với axit mạnh lẫn bazơ mạnh, thể hiện tính chất trung gian giữa hai loại oxit. Bên cạnh đó khi xét đến khía cạnh oxit, tên gọi khác của H2O là “đihiđro oxit“

H2O thể hiện tính bazơ khi tác dụng với axit
- Ví dụ: H2O + HCl → H3O+ + Cl−
- Khi tác dụng với axit mạnh như HCL, H2O sẽ nhận một proton (H+), nên đóng vai trò là oxit bazơ (oxide base)
H2O thể hiện tính axit khi tác dụng với bazơ
- Ví dụ: NH3 + H2O ⇌ NH4+ + OH−
- Khi tác dụng với một bazơ yếu, như NH3 đặc, H2O sẽ cho một proton (H+), nên đóng vai trò là oxit axit (oxide acid)
Tính chất lưỡng tính giúp làm rõ thêm khía cạnh hóa học khi tìm hiểu H2O là gì và vì sao có khả năng tham gia nhiều phản ứng khác nhau
9. H2O là lưu chất quan trọng trong ngành van và ống
H2O là một trong những lưu chất được sử dụng phổ biến nhất trong hệ thống đường ống công nghiệp và van nước nhờ tính chất ổn định, dễ kiểm soát và có mặt ở hầu hết các quy trình kỹ thuật. Trong thực tế, nước chiếm tỷ trọng lớn nhất trong vận hành của các nhà máy, tòa nhà và hệ thống kỹ thuật.
- Truyền nhiệt: H2O được dùng làm chất tải nhiệt trong hệ thống điều hòa, chiller, nồi hơi, trao đổi nhiệt và đường ống hơi nóng
- Lưu thông & phân phối: H2O là môi chất chính trong hệ thống cấp nước, phòng cháy chữa cháy (PCCC), tưới tiêu, xử lý nước và vận hành dây chuyền sản xuất
- Tạo áp lực & vận hành thiết bị: Nhiều loại van (van cổng, van bướm, van bi, van một chiều… được thiết kế với thông số thử nghiệm theo H2O vì tính ổn định và độ nhớt thấp
- Làm mát thiết bị, máy móc: Trong các ngành công nghiệp nặng như đúc kim loại, điện lực, hóa chất, H2O đóng vai trò làm mát liên tục cho hệ thống
- Xử lý và tinh lọc: Ở các nhà máy nước, hệ thống RO, UF, lọc cát hoạt động toàn bộ dựa trên H2O chảy qua mạng van, ống và bơm để tạo nước tinh khiết

Nói cách khác, H2O là gì không chỉ là môi trường vận chuyển mà còn là lưu chất tiêu chuẩn trong thiết kế, thử nghiệm và vận hành của toàn bộ ngành van, ống và thiết bị công nghiệp